La leucina y la regulación de la síntesis proteica muscular
Una explicación detallada sobre los mecanismos anabólicos vinculados a la hipertrofia
Los BCAA’s son esenciales en la dieta y, por lo tanto, relevantes en la regulación de la síntesis proteica muscular y como esto ya es más que conocido, un grupo de investigaciones fueron más allá para demostrar el efecto anabólico de una mezcla completa de aminoácidos; en uno de los ensayos se administraron glucosa y varias mezclas de aminoácidos por un periodo de una hora en ratones previamente privados de alimentación demostrándose que la infusión de BCAA y glucosa aumenta la síntesis proteica en el músculo esquelético tan eficientemente como una mezcla que contiene glucosa y todos los aminoácidos.
Este hecho sugiere que el efecto anabólico de una mezcla completa de aminoácidos puede ser reproducido por el suministro de una mezcla que contenga solo los tres aminoácidos ramificados (Garlick, Grant, 1998), pero el efecto de la mezcla de los tres BCAA’s sobre la síntesis proteica muscular puede ser atribuido al aminoácido leucina, ya que cientos de estudios con músculos esqueléticos dañados se demuestra que el suministro de leucina aisladamente estimula la síntesis proteica muscular bien específicamente.
El efecto anabólico
La leucina ejerce sus efectos en nivel post-transcripcional y más comumente durante la fase de iniciación de la traducción del mensajero RNA (mRNA) en proteína;
- El mecanismo por el cual la leucina estimula la traducción de proteínas está relacionado al hecho del aumento de la concentración intracelular de este aminoácido para promover la activación de una proteína quinasa denominada (mammalian target of rapamycin – objetivo de la rapamicina en mamíferos) o mTOR.
- La mTOR estimula la síntesis proteica principalmente por medio de tres proteínas reguladoras llaves; la proteína quinasa ribosomal S6 de 70 kDA (p70S6k); la proteína 1 ligante del factor de iniciación eucariótico 4E (4E-BP1); y el factor de iniciación eucariótico 4G (eIF4G).
En el gráfico se puede ver la señalización vinculada a la síntesis proteica mediada por la leucina, insulina, IGF-1 ante el esfuerzo físico
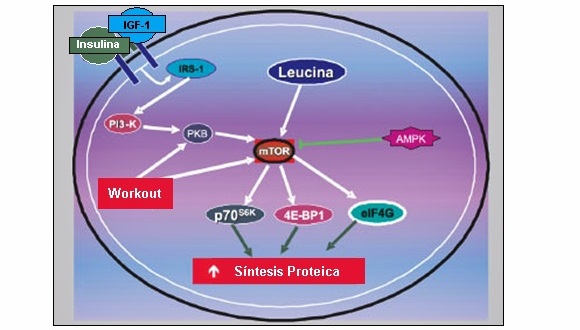
La 4E-BP1 es una inhibidora del factor de iniciación de la traducción proteica conocida como eIF4E y cuando la 4E-BP1 es fosforilada, la eIF4E es liberada y puede unirse a la eIF4G, la cual está también bajo el control de la mTOR y combinada a la eIF4A, forma el complejo eIF4F; y la fabricación de este complejo es necesario para continuar la etapa de iniciación de la traducción del mRNA en proteína.
- La mTOR también activa al p70S6k, que estimula la iniciación de la traducción así como la elongación de la síntesis proteica por diferentes mecanismos; la p70S6k cuando es activada, fosforila e inactiva la enzima quinasa del factor de elongación 2 (eEF2K), lo que permite que el eEF2 sea activado promoviendo la elongación.
- De acuerdo a esto, la administración de leucina a los roedores induce la hiperfosforilación de la 4E-BP1, promoviendo la formación del complejo eIF4F, causando la hiperfosforilación de la p70S6k y estimula la síntesis proteica.
- Similarmente, las dietas para ratones que contenían 20% de proteína estimulan la síntesis proteica hepática y muscular, que es asociada al aumento de la fosforilación de la 4E-BP1 y a la consecuente reducción de la conexión del eIF4E a la 4E-BP1, además del aumento de la formación del complejo eIF4F.
Todo este proceso permite relacionar la respuesta anabólica sobre la síntesis proteica muscular inducida por la ingesta de proteínas, por medio de la capacidad de la mTOR de detectar alteraciones en la concentración intracelular de leucina.
La leucina, interleucina y síntesis proteica muscular
La leucina influencia el control de corto plazo de la etapa de traducción de la síntesis proteica y este efecto es sinérgico con la insulina, que es una hormona anabólica con papel crítico en el mantenimiento de la síntesis proteica muscular; pero la insulina de modo aislado no es suficiente para estimular la síntesis proteica muscular en el estado post-absorción, siendo necesaria la ingesta de proteínas o de aminoácidos para restaurar completamente las tasas de síntesis proteica.
- El efecto de la insulina en la síntesis proteica muscular está relacionado al papel de esa hormona en potenciar el sistema de traducción de proteínas, en vez de regular directamente ese proceso; dicho de otro modo, la insulina ejerce un efecto permisivo sobre la síntesis proteica en la presencia de aminoácidos.
- Aliado a esto, se resalta que la administración oral de leucina produce un ligero y transitorio aumento en la concentración de insulina sérica que actúa también de modo permisivo para la estimulación de la síntesis proteica inducida por este aminoácido.
En estudios sobre la interacción entre los efectos estimulatorios de la leucina y de la insulina sobre la síntesis proteica en el músculo esquelético, se verifica que la administración de somatostatina, la cual inhibe la secreción de insulina atenúa el aumento inducido por la leucina sobre la fosforilación de la 4E-BP1 y de la p70S6k, sin embargo no tiene efecto sobre la asociación del eIF4E y eIF4G.
Además, ensayos con ratones diabéticos demuestran que parte de la respuesta de la leucina sobre la síntesis proteica en el músculo esquelético ocurre tanto por medio de mecanismos independientes de insulina como dependientes de insulina; por lo tanto se concluye que los efectos estimulatorios de la leucina sobre la síntesis proteica muscular ocurren por mecanismos dependientes de insulina que incluyen la señalización mediada por la proteína mTOR a la 4E-BP1 y a la p70S6k, mientras los efectos independientes de insulina son mediados por un mecanismo aún no totalmente esclarecidos que envuelve la fosforilación de la eIF4G y/o su asociación con la eIF4E.













