Dominio Mionuclear e Hipertrofia
Una visión resumida de como funciona el cuerpo humano y el papel de las células satélite en la homeostasia del tejido muscular sometido a estrés mecánico
Vamos a intentar explicar un tema bien interesante y complejo; que puede servir para el conocimiento previo al entrenamiento; cuando llegamos a un gimnasio oímos a los profesionales especializados decir que el ejercicio de fuerza es importante para generar miotraumas, pequeñas lesiones en el tejido muscular que son importantes para estimular la recuperación de ese tejido de manera más eficiente apareciendo entonces la importancia de esa herramienta para la profilaxia o prevención de lesiones incluso en otras modalidades deportivas.
Los estímulos de lesiones y sus beneficios
Nuestras células musculares presentan en su sarcolema una membrana de las células musculares además algunas células que se encuentran inactivas que son llamadas células satélites que al sentir algunos estímulos es capaz de dividirse, migrar y fundirse para colaborar a la regeneración y/o crecimiento del tejido muscular.
Después del estimulo al ejercicio ocurre la liberación de varías citocinas y agentes pro y anti-inflamatorios que son responsables por el disparo de varias cascadas de señalización celular específicas contribuyendo al estímulo de diferenciación de las células satélites en mioblastos, ocurriendo así la recuperación del tejido.
- Ante esas situaciones de trabajo pesado y estrés sucesivos debido al entrenamiento programado surge la hipertrofia, regidos por el principio del dominio nuclear en definición este dominio es el área total de sarcoplasma, citoplasma de las células musculares, y que es divida por el número de mionúcleos en la fibra muscular.
- Sabiendo que cada mionúcleo rige un determinado volumen celular y que el aumento del numero de núcleos derivado de la adhesión de las células satélites permite el aumento del volumen celular total, se concluye que cada mionúcleo será el responsable por un dominio de volumen igual al inicial sin perjuicio para la homeostasia de la fibra muscular.
Los mecanismos de hipertrofia muscular vinculada a la activación de las células satélites, entonces dependen de algunos factores entre los cuales el estímulo es el inicial en compensación con los nutrientes que provienen de la dieta y por supuesto de la suplementación natural.
Las células satélites son pequeñas células miogénicas, como citamos se encuentran en estado inactivo localizadas entre el sarcolema y la lamina basal de las fibras musculares; durante la vida extra-uterina estas células permanecen en estado de reposo, sin embargo dependiendo de esos estímulos, como el miotrauma son activadas, o sea, sintetizan diversas proteínas que contribuyen para modificar el status de esta célula y a partir de ahí ellas pueden diferenciarse en mioblastos, dividirse, migrar y fundirse, contribuyendo así para la regeneración y/o crecimiento del tejido muscular.
Sobre las células satélites
La fusión de la célula satélite con la consecuente cesión de su núcleo permite un aumento en la síntesis de proteínas aumentando las oportunidades de recuperación de esta célula, por su parte la diferenciación en mioblastos contribuye con la aparición de nuevas fibras llenando y recuperando la región lesionada.
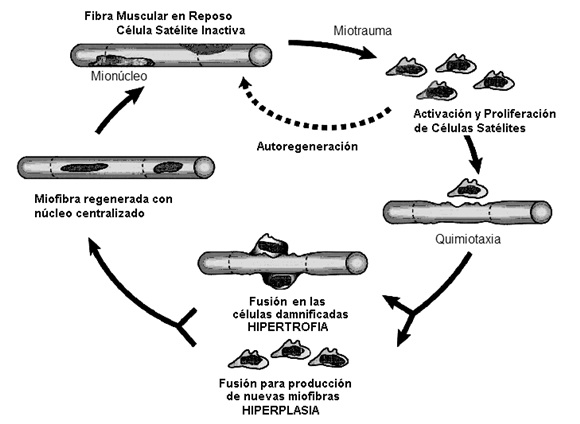
En la figura podemos ver la activación, diferenciación y proliferação de células satélites en la respuesta al daño muscular; varios factores liberados por el ejercicio o lesión activan las células satélites haciendo que estas dejen el estado inactivo; en este estado las células pueden proliferar y/o migrar, en ese caso al fundirse a los miócitos “damnificados”, contribuyen para la regeneración de la célula (adaptado de HAWKE y GARRY, 2001).
La proliferación, diferenciación y migración y los factores externos
El ejercicio es capaz de aumentar la producción y liberación del factor de crecimiento semejante a la insulina (IGF-I), factor de crecimiento de los fibroblastos (FGF), IL-6, y otras citocinas, etc;estos factores son responsables por el disparo de varías cascadas de señalización que contribuyen para la activación (diferenciación) de las células satélites.
- El IGF-I es uno de los principales factores de crecimiento; esta hormona peptídea es producida primordialmente en el hígado (efectos endócrinos), pudiendo ser también producida en otros tejidos para señalización local (efectos parácrino y autócrino).
- Se verifica en muchos estudios un aumento en la producción de esta hormona, y de su mRNA, inducidos por ejercicio.
- Los efectos de esta hormona son sinérgicos a los de la insulina (activación del transporte de glucosa y aminoácidos, síntesis de proteínas, síntesis de lípídos, etc.); además de estos efectos también estimulan la activación, proliferación y fusión de las células satélite.
El FGF y el factor de crecimiento de hepatócitos (HGF) son importantes factores estimuladores para las células satélites, pero parecen efectivos en diferentes épocas de la vida.
- Los estudios han demostrado que el FGF es uno de los factores determinantes en la proliferación de células satélite en roedores de diversas edades, sin embargo el HGF no demostró en general ser eficaz de la misma forma en los grupos jóvenes y ancianos.
- Los ratones ancianos fueron más beneficiados por la exposición al HGF del que los ratones jóvenes (YABLONKA-REUVENI et al., 1999).
Diversos factores factores pro y anti-inflamatórios son sintetizados durante y después del daño del tejido muscular; las prostaglandinas, tromboxanas y leucotrienos son producidas en respuesta ese daño tecidual con función pro-inflamatoria y son dependientes de la expresión y actividad de la enzima ciclo-oxigenasa (COX).
- Estas substancias contribuyen para la activación de las células satélite, principalmente las prostaglandinas, lo que ha estimulado a hacer estudios con inhibidores de la actividad de la COX y la regeneración muscular.
- Los resultados ha mostrado una disminución de la reparación muscular en la inhibición de la COX, haciendo polémica la utilización de los fármacos anti-inflamatórios.
Como está bien descrito en la literatura que en el proceso de regeneración muscular ocurre alta proliferación de las células satélites y la consecuente fusión de estas las células damnificadas; Adams (2006) relata que también puede ocurrir fusión de las células satélite independiente de las lesiones o estímulos provocados por el ejercicio como descrito anteriormente inducen migración, proliferación y principalmente la fusión incluso en la ausencia de injúrias.
- La cesión del núcleo proporciona un efecto de aumentar la capacidad de hipetrofia.
- Algunos autores defienden el concepto del dominio nuclear citado arriba en donde cada mionúcleo sería responsable por la homeostasia de un determinado volumen celular (dominio).
- El aumento del número de núcleos proporcionado por la adhesión de las células satélites permite un aumento del volumen celular total, pues cada mionúcleo puede ser responsable por un dominio de volumen igual al inicial sin perjuicio para la homeostasia de la fibra.
Dominio mionuclear e hipertrofia
En el siguiente modelo de hipertrofia muscular para explicar la implicación de las células satélites podemos ver los estados propuestos
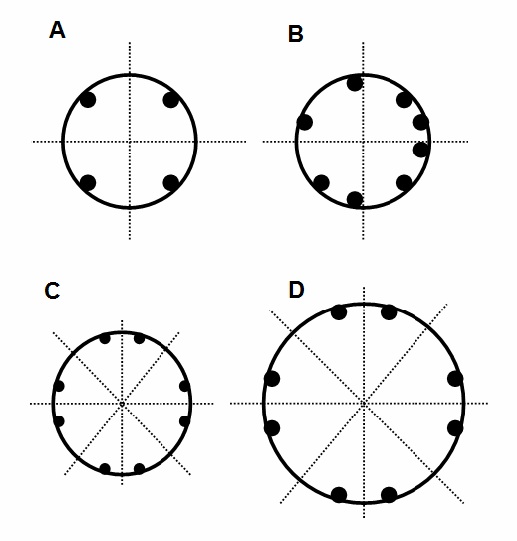
- (A) Fibra muscular multinucleada sufre acción mecánica, las líneas punteadas representan los límites de dominio para cada núcleo.
- (B) Las células satélites migran y se funden cediendo sus núcleos.
- (C) Cada mionúcleo pasa a ser responsable por un dominio.
- (D) La síntesis de proteínas aumenta el volumen celular total, siendo cada mionúcleo responsable por el mismo volumen celular de (A).
Algunos de los mecanismos a los cuales estas células son activadas aún no están totalmente esclarecidos, pero es consenso en el medio científico la importancia de estas células para el ajuste del músculo esquelético al ejercicio y al trauma.
Este consenso ha llevado diversos investigadores a la tentativa de aplicación de los conocimientos obtenidos en terapias para diversas enfermedades, síndromes y en la propia sarcopenia inducida por el envejecimientos; además las técnicas de cultivo de células satélites para posterior re-implante han sido desarrolladas como medio para tratar enfermedades degenerativas como la distrofia muscular de Duchenne, con éxitos aún son limitados pero con un futuro promisorio en la medicina.













